随着基因与细胞治疗领域的快速发展,基因编辑技术,尤其是以CRISPR/Cas为代表的技术,已经成为生物医学研究和应用中的革命性工具。它能够精准地对生物体的DNA进行编辑,纠正基因突变或增加新的遗传特征。然而,基因编辑的有效性、精确性和安全性受多种因素的影响。对这些因素的深入了解对于提高编辑效率、降低脱靶效应、以及实现临床应用至关重要。基因编辑过程中的一些关键因素,包括引导RNA(gRNA)设计、Cas酶的特性、目标位点的选择、细胞环境和编辑工具的递送方式。
01 引导RNA(gRNA)的设计与优化
引导RNA(gRNA)是基因编辑过程中最关键的组成部分之一,它决定了Cas核酸酶切割的目标位点。gRNA的设计直接影响编辑的特异性和效率。
1 gRNA长度与序列特性
gRNA的长度和序列在靶向DNA时发挥着重要作用。通常,gRNA由20个核苷酸的序列组成,这段序列必须与目标DNA高度匹配,尤其是在靶点附近的“种子序列”(Seed Region),这是确保Cas酶特异性切割的关键区域。设计过长或过短的gRNA可能导致Cas酶的活性降低,或者导致更高的脱靶效应。
2 gRNA与脱靶效应
尽管gRNA的靶向机制较为精确,但少量的错配仍可能触发Cas酶对非靶DNA的切割,导致脱靶效应。研究表明,错配发生在gRNA的种子区以外时,脱靶的概率更高。因此,优化gRNA序列,特别是在设计时考虑到潜在的脱靶位点,可以显著降低脱靶效应。例如在线工具CRISPROR、CHOPCHOP、CRISPRRGEN Tools、CRISPR-GE、CRISPR-P等可以帮助设计高效低脱靶的gRNA。

02 Cas核酸酶的特性
Cas核酸酶是CRISPR系统的核心,它通过gRNA引导,在目标位点切割DNA。Cas酶的特性决定了编辑的精度和效率,因此其优化和选择对基因编辑成功与否至关重要。
1 Cas9的特异性
CRISPR/Cas9系统的原始形式来自于细菌免疫系统,但为了在人类细胞中应用,研究人员对Cas9进行了多次改造。标准的Cas9(如来自链球菌的SpCas9)虽然能精准切割目标位点,但其相对较高的脱靶率限制了在临床中的广泛应用。为了解决这一问题,科学家开发了高保真版本的Cas9,通过对酶的活性位点进行精细调控,提高了靶点识别的精确度,从而减少了非目标序列的切割。
2 其他Cas核酸酶
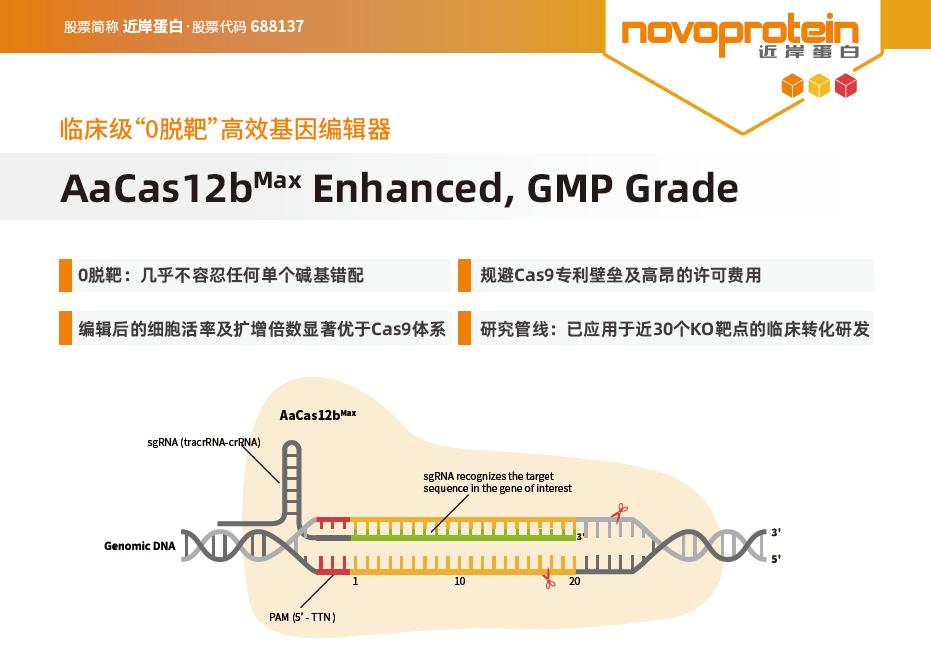
除了提高Cas9特异性的高保真版本外,研究人员还开发了其他Cas核酸酶,如Cpf1(Cas12a)、Cas12b、C2c2(Cas13a)等,这些酶在靶向机制和切割方式上有所不同。Cas12b切割DNA时生成的是黏性末端,而不是Cas9的平端,这使其具有提高配对和重组效率、增强连接精确性、促进同源重组修复、减少随机突变、提高基因插入的成功率等优势。
03 目标位点的选择
选择合适的基因编辑位点对于确保高效和精确的DNA切割至关重要。目标位点的选择主要受到基因组序列、PAM序列要求和脱靶位点分布的影响。
1 PAM序列要求
Cas酶的切割需要靶点附近存在特定的PAM序列。如果目标位点附近没有合适的PAM序列,Cas酶将无法发挥作用。不同的Cas酶对PAM序列的要求不同,因此,对PAM序列要求不一致的核酸酶,无法共用gRNA。
2 靶点的基因组环境
目标位点的基因组环境也会影响基因编辑的效率。某些基因组区域由于DNA折叠、表观遗传修饰(如甲基化)等因素,可能难以被Cas酶和gRNA识别或结合。尤其是在染色质高度紧密的区域,Cas酶和gRNA难以有效结合,从而降低了编辑效率。基因组的开放区域,如富含转录活性基因的区域,通常是更理想的编辑靶点。
04 细胞类型和编辑环境
不同细胞类型在基因编辑中的反应可能有所不同,细胞内的DNA修复机制、染色质状态以及细胞周期都会影响编辑效率和结果。
1 DNA修复机制
基因编辑后,细胞通过内源性的DNA修复机制修复双链断裂(DSB)。DSB可激活细胞的DNA损伤修复机制,非同源性末端结合 ( Non-homologous End Joining, NHEJ ) 或同源重组介导的修复 ( Homology Directed Repair, HDR ) 。NHEJ,即易错修复,会在修复位点引起随机插入或缺失,造成移码突变,使得基因不再表达,由此形成基因敲除。HDR,即精准修复,能借助外源引入的单链或双链DNA为模板介导基因替换或插入,这种方式可以将一段DNA序列精准地插入特定的基因组位点,由此完成基因敲入或替换。通过调控细胞周期或提供外源性同源模板,可以提高编辑的精确性。
2 染色质状态
染色质的开放或封闭状态也会影响基因编辑的成功率。在活跃转录区域的染色质通常处于开放状态,gRNA和Cas酶更容易接近这些区域进行编辑。而在异染色质区域,由于DNA高度折叠,Cas酶难以发挥作用。因此,靶点位于异染色质区域的编辑可能效率较低。
05 基因编辑工具的递送方式
将CRISPR系统(包括Cas酶和gRNA)准确、高效地送入目标细胞是成功编辑的前提之一。常见的递送方式包括病毒载体(如腺相关病毒,AAV)、电穿孔和脂质体介导的转染。
1 病毒载体
病毒载体(如AAV)是高效的基因编辑工具交付系统,能够将CRISPR系统精确地引入目标细胞。AAV具有较高的转导效率,特别适合体内基因编辑。然而,病毒载体的局限性包括载荷容量有限(AAV的最大包装容量为4.7kb),难以同时携带Cas酶和gRNA。
2 非病毒载体
非病毒载体包括脂质体、电穿孔等方法。电穿孔是一种高效的物理方法,通过电场短暂穿孔细胞膜,将CRISPR系统送入细胞中。非病毒载体的优点是安全性高,但在某些情况下转染效率较低。
基因编辑是一项复杂且多因素驱动的过程,编辑效率和保真性受多方面影响,包括gRNA设计、Cas酶的特性、目标位点的选择、细胞环境以及编辑工具的递送方式等。需要全面考虑和优化这些因素,才能提高基因编辑的成功率,减少脱靶效应,确保技术的安全性和有效性。
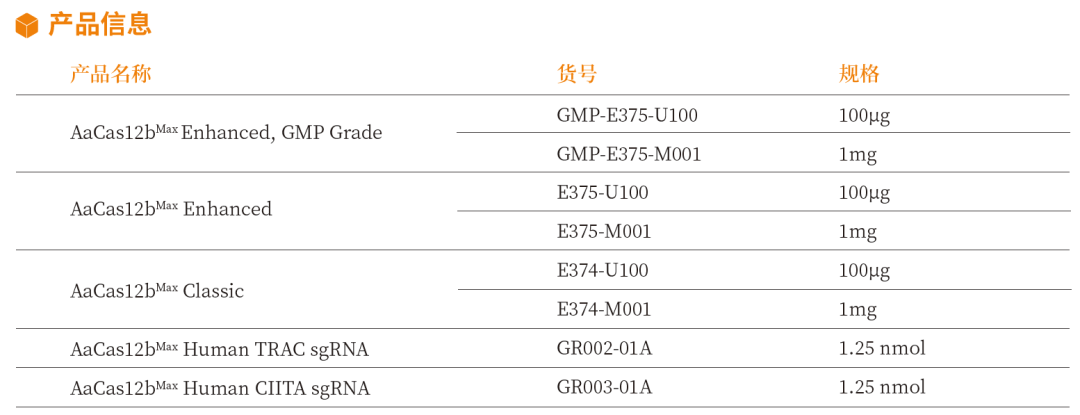
近岸蛋白基于成熟的规模化GMP级生产平台,提供GMP级、RUO级AaCas12bMax 蛋白。同时,为了便于客户能够快速拿到测试结果,近岸蛋白还可提供通用靶点优选sgRNA或sgRNA序列*。
- 可提供sgRNA序列:B2M、TRAC、CIITA、PD1、CD7
- 可提供合成好的sgRNA:TRAC、CIITA
*通用靶点sgRNA序列由天泽云泰筛选并提供,大中华区企业可在签订协议后免费获得靶点(B2M、TRAC、CIITA)在细胞治疗领域的全球范围管线开发及商业化授权。